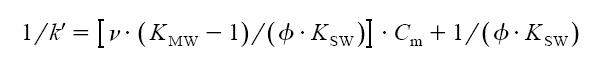Micelární kapalinová chromatografie
Tento příspěvek vznikl na základě přednášky Prof. P. Jandery prezentované na konferenci HPLC 2008 ve Skalském dvoře, za což mu tímto děkuji
Úvod
Povrchově aktivní látky neboli tenzidy jsou látky amfofilního charakteru, obsahující nepolární alkyl a polární skupinu nebo skupinu s kladným či záporným nábojem. Jejich unikátních vlastností bylo využito při vývoji separačních technik v kapalné fázi. V kapilární elektroforéze se tenzidy využívají k modifikaci povrchu kapilár z taveného křemene za účelem zlepšení separace bílkovin a dalších biopolymerů. V kapalinové chromatografii se tenzidy používají nejčastěji při chromatografii iontových párů, umožňující separovat látky iontového charakteru v systémech s s převrácenými fázemi. Separace je založena na tvorbě neutrálních iontových asociátů mezi vzorky a iontovými tenzidy, nesoucími opačný náboj (nejčastěji kvarterní amoniové soli, terciární či sekundární aminy s alkyly celkovým počtem 6 - 16 atomů uhlíku pro separace aniontů organických kyselin nebo alkansulfonové kyseliny či alkylestery kyseliny sírové s 5 - 12 atomy uhlíku pro separace organických bazí).
V oblasti nízkých koncentrací jsou tenzidy přítomny ve vodných roztocích jako monomery nebo jsou pouze slabě agregované (dimery, trimery). Dosáhne-li koncentrace tenzidu tzv. kritické micelární koncentrace (CMC), mononery se začnou shlukovat do agregátů - micel - sestávajících obyčejně ze 60-100 monomerů (agregační číslo). Micely vznikají vlivem hydrofobního odpuzování mezi uhlíkovými řetězci a vodným prostředím a přitažlivých sil mezi nepolárními uhlíkovými řetězci uvnitř micel. Jestliže koncentrace tenzidu dále stoupá, vzrůstá koncentrace micel, zatímco koncentrace volného tenzidu zůstává na konstantní úrovni rovné CMC. Makroskopické vlastnosti micelárního roztoku jsou stejné jako vlastnosti pravého roztoku, mikroskopicky se ovšem roztok chová jako dynamická heterogenní soustava složená z nabitých „kapiček oleje“ ve vodném prostředí.
Nejznámější využití micel v elektromigračních technikách představuje micelární elektrokinetická chromatografie (MEKC) pro separace neiontových látek, kde vytvářejí shluky molekul, označovamé jako micely, tzv. "pseudofáze" v pracovním elektrolytu. MEKC separace jsou založeny na distribuci látek mezi vodným elektrolytem a micelami, nejčastěji anionických tenzidů, které migrují v kapiláře proti směru elektroosmotického toku, unášejícího vodný elektrolyt. Analogií MEKC v kapalinové chromatografii je tzv. micelární kapalinová chromatografie (MLC), kde micely slouží jako částečná nebo úplná náhrada polárního organického rozpouštědla (methanolu nebo acetonitrilu) ve vodně-organické mobilní fázi v systémech s převrácenými fázemi.[1]
Využití tenzidů v analytické chemii naleznete zde
Princip retence
Armstorng a Henry[2] jako první demonstrovali použití mobilních fází s koncentrací tenzidu nad CMC v kapalinové chromatografii. Princip separace je založen na rozdělování analyzovaných látek mezi třemi fázemi: vodnou fází, micelární pseudofází a stacionární fází pokrytou tenzidem. V MLC systémech s převrácenými fázemi dochází k výrazné adsorpci tenzidu na stacionární fázi v koloně.[3] Se zvyšující se koncentrací tenzidu v mobilní fázi rychle stoupá koncentrace tenzidu ve stacionární fázi, překročí-li však koncentrace v mobilní fázi CMC, koncentrace ve stacionární fázi dále již výrazně nestoupá, protože se veškerý další tenzid váže přednostně do micel.[4] Při popisu retence analyzovaných látek se vychází z třífázové rovnováhy látky mezi vodnou fází, micelární pseudofází a tenzidem pokrytou stacionární fází, přičemž přímý transport látky z micely do stacionární fáze lze většinou zanedbat. Termodynamickou rovnováhu lze vyjádřit obrázkem:
|
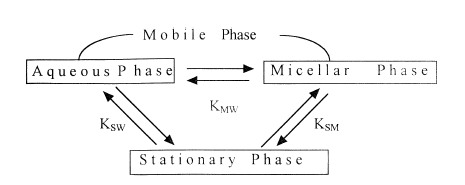
Termodynamiku retence lze popsat rovnicí, která vyjadřuje závislost reciproké hodnoty kapacitního poměru na micelární koncentraci:
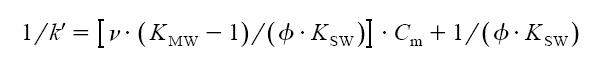
|
kde k´ je kapacitní faktor solutu, KSW je rozdělovací konstanta solutu mezi stacionární fázi a vodu, KMW je rozdělovací konstanta solutu mezi micelami a vodou, f je fázový objem, n je molární objem tenzidu, Cm je micelární koncentrace tenzidu, KSM je rozdělovací konstanta solutu mezi stacionární fází a micelami vyjádřená jako KSW/KMW.
Další modely retence popsal Foley[5] a Garcia-Alvarez-Coque a spol.[6]
Mobilní fáze v MLC
Jako mobilní fáze při MLC se používají vodné roztoky různých tenzidů, nejčastěji aniontového dodecylsíranu sodného (SDS), méně často kationtového hexadecyltrimethylamonium bromidu (CTAB), či neiontového polyoxyethylen(23)dodekanolu (Brij-35). Výhodou MLC je větší šetrnost k životnímu prostředí při likvidaci odpadních mobilních fází: relativně nízké koncentrace tenzidů částečně nebo zcela nahrazují organická rozpouštědla. Při MLC lze často dosáhnout lepší selektivity separace polárních látek ve srovnání s "klasickou" RP HPLC. Micely zpomalují fotodegradaci některých léčiv, citlivých na světlo, mohou zvyšovat kvantový výtěžek fluorescence a citlivost HPLC separace s fluorimetrickou detekcí.
Nejčastěji používané tenzidy v MLC a jejich vlastnosti
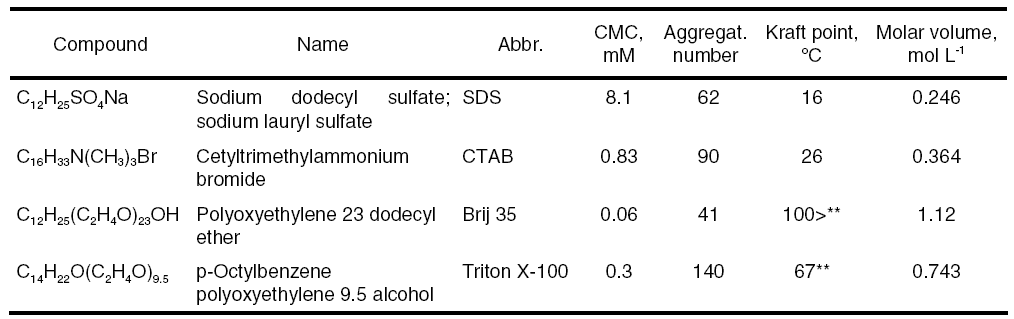
|
Praktické aplikace
Největší výhoda MLC se projeví při analýze a stanovení látek v biologickém materiálu, protože většinou odpadá problém s úpravou vzorků před analýzou (srážení bílkovin a jejich oddělování), který se vyskytuje při použití klasických vodně-organických mobilních fází. Micely v mobilní fázi solubilizují bílkovinnou matrici biologického vzorku, takže nedochází k ucpání kolony vysráženou matricí vzorku. Jako micelizační činidlo nemůže být použit CTAB, protože špatně solubilizuje bílkoviny, dobré výsledky jsou s ionickým tenzidem SDS nebo neionickým Brij-35. Je udávána vysoká návratnost analyzovaných léčiv z biologických matric (> 90 %) i pro látky silně vázané na bílkoviny.[7] Micelární mobilní fáze může být také použita pro odstranění matrice vzorku v obohacovacím a čistícím stupni, který předchází vlastní separaci a stanovení na analytické koloně. Při použití opticky aktivních micelárních mobilních fází s cholovými kyselinami je možné separovat i optické izomery analyzovaných látek.[8]
Nevýhody MLC
Nevýhodou micelární kapalinové chromatografie je poněkud nižší účinnost separace ve srovnání s kapalinovou chromatografií s vodně-organickými mobilními fázemi, která je způsobena poklesem difúzních koeficientů analyzovaných látek v micelách. Tento nedostatek může být částečně potlačeny zvýšením pracovní teploty (40 °C) nebo přídavkem organického rozpouštědla k "hybridní" vodně-organické micelární mobilní fázi. Přídavek organického rozpouštědla potlačuje sorpci tenzidu na stacionární fázi,[9] nesmí však překročit hranici (cca 20 - 30%), nad níž již nedochází k aregaci micel. Další výraznou nevýhodou MLC je nekompatibilita mobilní fáze s technikou LC-MS.
Literatura
[1] Berthod A., Garcia-Alvarez-Cocque, M.C., v knize: Micellar Liquid Chromatography, Cazes, J., editor, Marcel Dekker, New York 2000.
[2] Armstorng D.W., Henry S.J.: J. Liq. Chromatogr. 3 (1980) 657.
[3] Berthod A., Girard I., Gonnet C.: Anal. Chem. 58 (1986) 1362.
[4] Jandera P., Fischer J.: J. Chromatogr. A 728 (1996) 279.
[5] Foley J.P.: Anal. Chim. Acta. 231 (1990) 237–247.
[6] Garcia-Alvarez-Coque M.C., Torres-Lapasio J.R., Baeza-Baeza J.J.: Anal. Chim. Acta. 324 (1996) 163–173.
[7] Ruíz-Ángel M.J., Garcia-Alvarez-Cocque, M.C.: LC-GC Europe 21 (9) (2008) 420.
[8] Hu W., Takeuchi T., Haraguchi H.: Chromatographia 33 (1992) 58.
[9] Armstorng D.W., Henry S.J.: J. Liq. Chromatogr. 3 (1980) 657.
Last modified: