Hydrofobní interakční chromatografie – HIC
Na hydrofobní interakční chromatografii může být pohlíženo jako na nástavbu reverzní chromatografii s vodnými mobilními fázemi bez přídavků organických rozpouštědel. Retence solutů je ovlivňována pří-davkem organických nebo anorganických solí do vody. Chromatografie HIC byla primárně použita pro separaci proteinů, protože v přítomnosti organických rozpouštědel v mobilní fázi vede často k denaturaci proteinů a navíc zůstává zachována biologická aktivita proteinů. K separaci proteinů se namísto isokratické eluce používá eluce gradientová a to gradientová eluce se snižující se iontovou sílou mobilní fáze (opak iontové chromatografie).
Obsah
Retenční mechanismus
V HIC je retence nastartována vodnou mobilní fází s vysokou koncentrací solí a eluce je dosažena snižováním koncentrace soli. Stacionární fáze musí být velmi hydrofilní a má pouze velmi malé hydrofobní vlastnosti. Zvýšením koncentrace soli v mobilní fázi dochází k přechodu solutu do stacionární fáze a dochází ke zvýšení retence. Proteiny a hydrofilní polymery jsou velmi dobře rozpustné ve vodě a přídavkem solí do vody může docházet k jejich vysrážení resp. tzv. vysolení. Tyto mechanismy pak mohou vysvětlit retenční mechanismus HIC. Soluty rozpuštěné ve vodě jsou těsně obklopené molekulami vody a přídavek solí do mobilní fáze redukuje množství volné vody. Současně molekuly vody, které obklopují hydrofobní povrch stacionární fáze se uvolňují do mobilní fáze a molekuly solutu jsou přístupnější k interakcím s hydrofobním povrchem. Uvolnění vody z hydrofobního povrchu doprovází zvýšení entropie systému. Následkem toho pak zvýšení teploty často vede ke zvýšení retence.
Kvantitativně můžeme retenci vyjádřit rovnicí, [1],[2] která vyjadřuje závislost molální koncentrace soli ms na retenční faktor:
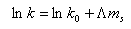
|
kde k0 je retenční faktor pro nulovou koncentraci soli v mobilní fázi a L je experimentální konstanta. Rovnice vyjadřuje lineární závislost mezi logaritmem retenčního faktoru a molální koncentrací soli, což je skutečně také pozorováno.
Selektivita
Zatímco retence v HIC je uskutečňována gradientem iontové síly mobilní fáze, na selektivitu separace má vliv použitá stacionární fáze, typ soli, teplota, pH a další použitá aditiva v mobilní fázi.
Zvýšení retence je dáno koncentrací soli a závisí na druhu použité soli – kationu i anionu soli a retenční síla soli je úměrná tzv. příspěvku molální povrchové tense s (dyn.g/cm/mol). Platí, že čím vyšší hodnota s tím vyšší retence při dané koncentraci soli v mobilní fázi. Nejpoužívanější solí je síran amonný (? = 2,16.103) jehož limit rozpustnosti je asi 4 mol/l a další soli jsou používány k ovlivnění selektivity – chlorid sodný (s = 1,64.103), síran sodný (s = 2,73.103) nebo hydrogenfosforečnan sodný (s = 2,02.103).
Dalším způsobem ovlivnění selektivity je změna pH, ale změna pH mobilní fáze není tak silným nástrojem jako v iontové chromatografii.
Důležitým aspektem ovlivnění retence v HIC je změna teploty separace. Při vyšší teplotě klesá viskosita mobilní fáze a obdobně jako se snížením koncentrace soli klesá retence solutu. Nižší viskosita mobilní fáze má za následek ostřejší píky a lepší separaci. Nižší teplota je naopak vhodná pro separaci proteinů, které jsou tepelně labilní.
V hydrofobní interakční chromatografii můžeme ovlivnit retenci také přídavkem organického rozpouštědla. Typické rozpouštědlo v HIC je glycerol, ethylenglykol nebo ethylenglykol monoethylether.
Stacionární fáze
Stacionární fáze pro HIC můžeme rozdělit do dvou skupin: skupina A zahrnující homogenní povrch stacionární fáze a skupina B obsahující stacionární fáze s nízkou populací hydrofobních funkčních skupin. Skupina A zahrnuje často stacionární fáze pro vodnou gelovou permeační chromatografii, patří sem např. ace-tamidová fáze, etherové fáze,což jsou chemicky vázané fáze na bázi silikagelu. Do skupiny B patří fáze na bázi krátkých alifatických řetězců jako propyl nebo butyl nebo fenylové skupiny. Hustota vázaných ligandů je 2krát menší než hustota ligandů u klasické reverzní fáze.
Aplikace
HIC se používá především k separaci proteinů a velkých peptidů. Kapacita HIC je srovnatelná s ka-pacitou chromatografie GPC, ale množství dávkovaného vzorku je příliš komplikované. Je to dáno tzv. vysolovacím efektem, kdy je rozpustnost proteinů ve vysoce koncentrovaných solích omezena. Objem nástřiku není příliš velký a vzorek se rozpouští přímo v primárním pufru, který se nastřikuje na kolonu. Je-li vzorek rozpustný ve vodě nebo slabém pufru, pak se mohou na kolonu dávkovat pouze velmi malé objemy vzorku, protože voda je v HIC velmi silou mobilní fází. Na druhé straně však může mít přídavek soli do solventu vliv na rozpustnost proteinu a může docházet k jeho vysrážení. Koncentrace soli ve vzorku musí být proto optima-lizována a má za následek omezení HIC k rozšíření v preparativní chromatografii. Dalším problémem aplikace HIC je použití právě vysoce koncentrovaných pufrovaných mobilních fází což má za následek vysoké nároky na použitou instrumentaci HPLC (čerpadla, nástřiková zařízení).
Literatura
[1] Melander W., Horváth Cs.: Arch. Biochem. Biophys. 183, 393 (1977).
[2] Horváth Cs., Melander W., Molnar I: Anal. Chem. 49, 142 (1977).
Last modified: