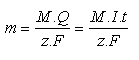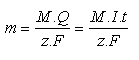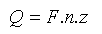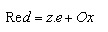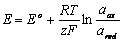Elektrochemická derivatizace
Látky schopné přimout nebo odevzdat elektrony prostřednictvím nabité elektrody se označují jako elektroaktivní částice (depolarizátory). Hmotnost vznikajících produktů m [g] je přímo úměrná spotřebovanému náboji Q [C] = první Faradayův zákon (V praxi se užívá jednotky soustavy SI 1 Coulomb = 1 C. Tato jednotka je definována jako náboj částic, které projdou za 1 s průřezem vodiče, kterým prochází proud 1 A. Platí 1 C = 1 A s−1.), dále pak molární hmotnosti M [g mol−1] a nepřímo úměrná počtu přenesených elektronů z = druhý Faradayův zákon. Pomocí tzv. Faradayova náboje F (F = 96 484 C mol−1) byl formulován spojený Faradayův zákon:
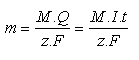
|
kde I [A] je proud procházející v čase t [s] roztokem látky. Pro obecnou elektrochemickou reakci, kde se mezi elektrodou a výchozí látkou obecně přenes z elektronů, platí:
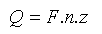
|
Například pro redukci nitrobenzenu na anilin (z=6) je třeba pro získání 0,001 molu anilinu 578,9 C mol−1.
Základními typy elektrodových reakcí jsou anodická oxidace, při které přecházejí elektrony z látky na elektrodu, a katodická redukce, při níž se elektrony pohybují opačným směrem.[1] Při posuzování redoxního charakteru reakce lze sledovat, jak na jednotlivých atomech výchozí sloučeniny dochází k elektronovému obohacování (redukci) nebo ochuzování (oxidaci). Počet vyměněných elektronů mezi látkou a elektrodou se zjistí porovnáním celkového oxidačního stupně výchozích látek a produktů. Musí plati zákon zachování hmoty a náboje - celkový oxidačnáí stupeň produktu musí být vyšší o hodnotu, která odpovídá počtu odevzdaných elektronů při anodické oxidaci, nebo nižší o počet elektronů přijatých katodou pri redukci. Oxidační číslo prvku ve sloučenině je definováno jako elektrický náboj vyjádřený počtem elektronů, který daný atom přijal nebo odevzdal svému okolí, aby se stal součástí vazebného systému. Jinak řečeno oxidační číslo je dáno součtem všech elektronů, které atom ze svého okolí přijal nebo do něj odevzdal.
Proces, kdy dochází při interakci elektrody s elektroaktivní částicí (substrátem) k výměně elektronů, sestává ze tří po sobě následujících dějů - (a) přenos hmotných částic substrátu ve směru k elektrodě (transportní děj I), (b) přenos náboje mezi elektrodou a substrátem, které jsou ve vzájemném dotyku (dojde ke vzniku intermediátu) a (c) přenos hmotných částic intermediátu, které se pohybují směrem od elektrody do roztoku (transportní děj II). Nejpomalejší ze souborů dějů určuje celkovou rychlost reakce. Transport hmotných částic je zprostředkován difuzí, přenos náboje je následován migrací. V případě kontinuálního toku kapaliny, jak je tomu v kapalinové chromatografii, je určující rychlostí přenos elektronu mezi substrátem a elektrodou. Rychlost elektrodové reakce závisí na koncentraci výchozích látek, teplotě a na potenciálu elektrod. Elektrodový potenciál řídí způsob průběhu elektrochemické reakce, její rychlost a počet vyměňovaných elekronů. Přímé elektrochemické přeměny obecně zahrnují rovnováhu mezi oxidovanou a redukovanou formou:
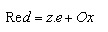
|
Ve vztahu k potenciálu jsou charakterizovány Nernstovou-Petersonovu rovnicí:
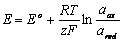
|
Člen E° v rovnici je tzv. standardní potenciál, při kterém jsou aktivity aox a ared shodné.
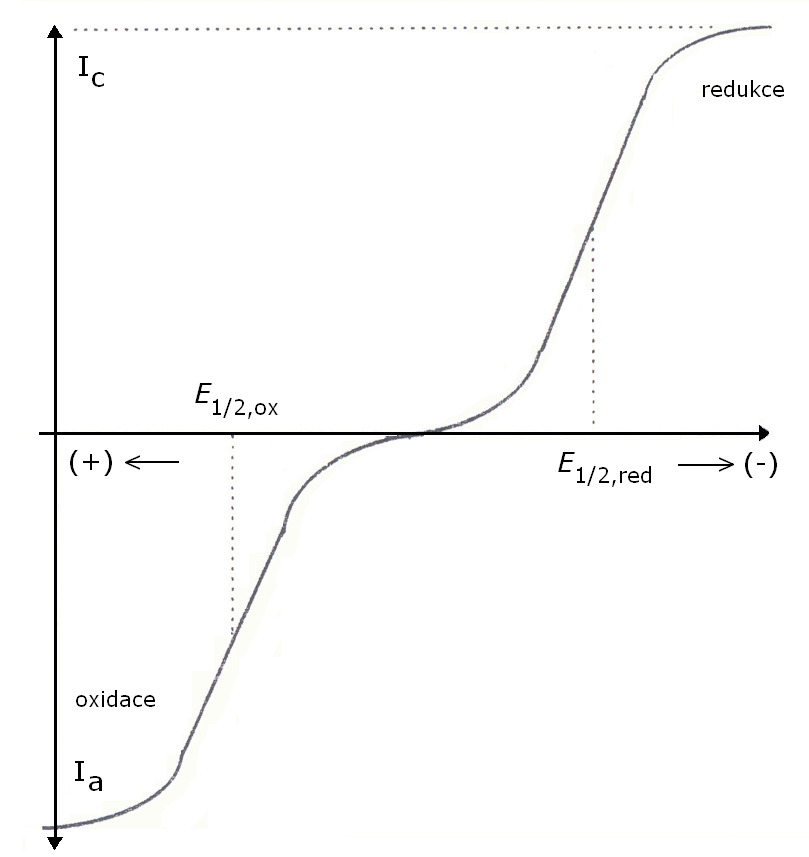
Závislost koncentrací redukovaných a oxidovaných forem látek v roztoku (cox a cred) na hodnotách elektrického proudu určuje charater elektrodového procesu. Jeho obrazem jsou redoxní voltametrické křivky obrázek č.1.
Obr. 1 Voltamperometrická křivka
|
Chromatografické podmínky, zejména složení mobilní fáze, má podstatný vliv na průběh, rychlost a výtěžek elektrochemické derivatizace (podstatný je jak bylo popsáno výše elektrodový potenciál). pH mobilní fáze má vliv na průběh a rychlost reakce. Mnohdy je pH optimum redoxní reakce mimo meze pH a není tak kompatibilní s použitou reverzní fází (pH <2 nebo pH >10). Mobilní fáze musí být vodivá a proto se používají různé pufry, které jsou přenašečem činidla (elektronů). ke zvýšení vodivosti je možné použít jako aditivum mobilní fáze chloristan amonný (0,05 M) nebo octan sodný (0,05 M). Koncentrace pufru v mobilní fázi má vliv na zbytkový proud a se zvyšující se koncentrací roste šum a drift základní linie. Jako soli se používají fosfáty, acetáty a citráty, použití aminů by mělo být omezeno na minimum. Z organických modifikátorů je nejvhodnější acetonitril, methanol má určitá omezení (do potenciálu elektrody + 1,0 V). Vliv zbytkového kyslíku v mobilní fázei je dostatečně známý a proto by měla být mobilní fáze dostatečně odvzdušněna.
Jako elektrochemický derivatizační reaktor (elektrolyzér, cela) je možné použít amperometrickou nebo coulometrickou celu. Výtěžek derivatizační reakce je u coulometrických cel daleko vyšší než v případě amperometrické cely (do styku s roztokem přichází pouze povrch elektrody, u coulometrické cely je možné použití tzv. cely fritového typu, kdy mobilní fáze protéká porézní grafitovou pracovní elektrodou). Nevýhodou coulometrické cely je možnost její pasivace a víceméně nemožnost jejího mechanického vyčištění, což je v případě použití amperometrické cely jednodušší. K elektrochemické derivatizaci je možné použít on-line zapojený amperometrický nebo coulometrický detektor, což je ale poměrně drahé řešení a používalo se zejména dříve. V současné době jsou komerčně dostupné derivatizační elektrochemické cely od firmy ESA Inc.
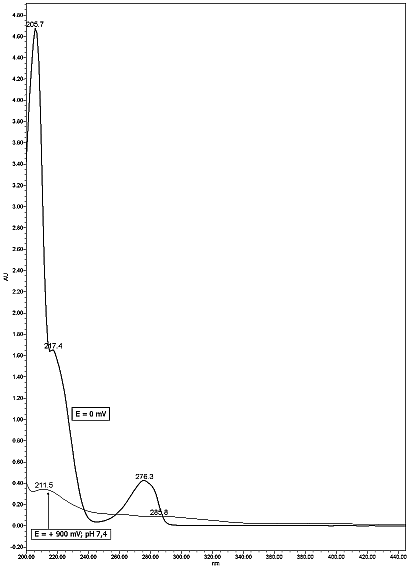
Elektrochemická konverze analytů na deriváty detekovatelné UV nebo fluoresceční detekcí byla popsána již v 80.letech 20 století. Jako pěkný příklad je možné uvést oxidaci katecholaminů na vysoce fluoreskující ocidační produkty[2] nebo redukce vitaminu K na fluoreskující derivát.[3] K separaci vitaminu K se použila kolona Hypersil MOS a mobilní fáze methanol - voda (95+5) obsahující 0,03 M NaClO3 ke zvýšení vodivosti mobilní fáze. K redukci se použilo napětí - 400 mV, produkt se detekoval při 420 nm s excitační vlnovou délkou 320 nm. Z nojvějších prací lze uvést stanovení fenolů s on-line elektrochemickou derivatizací a fluorescenční detekcí.[4] Fenoly jsou oxidovány při + 900 mV za vzniku oxidačních dimerů a oligomerů, které výrazně fluoreskují při 405 nm s excitační vlnovou délkou 320 nm. Změna stuktury resorcinolu při jeho oxidaci E = + 900 mV, pH 7,4 je patrná ze změny jeho UV spektra (obrázek č.2).
Obr. 2 UV spektrum resorcinolu před oxidací (silná čára) a po oxidaci E = + 900 mV (tenká čára)
|
[1] Shono T., Matsumura Y., Nakagawa Y.: J. Am. Chem. Soc.96, 3532 (1974).
[2] Schieffer G.W.: Anal. Chem. 53, 126 (1981).
[3] Langerberg J.P., Tjaden U.R.: J. Chromatogr. 305, 61 (1984).
[4] Mayer J., Liesener A., Gotz S., Hayken H., Karst U.: Anal.Chem. 75, 922 (2003).
Last modified: