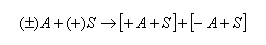CHIRÁLNÍ SEPARACE
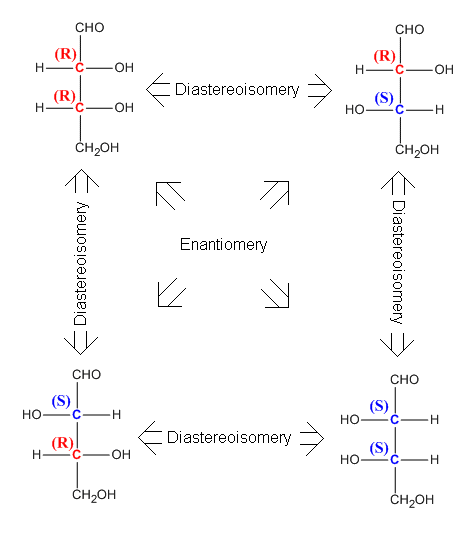
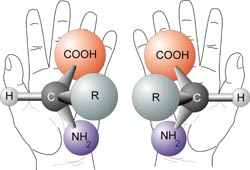
Molekuly se shodným sumárním a konstitučním vzorcem, lišící se prostorovým uspořádáním (konfigurací) na jednom nebo více stereogenních centrech (obvykle na tzv. asymetrických uhlíkových atomech = chirálních centrech) jsou nazývány stereoizomery. Každý stereoizomer má svoji jedinečnou konfiguraci, kterou je možné převést na jinou konfiguraci pouze chemickými prostředky. Existují dvě významné třídy stereoizomerů: enantiomery a diastereomery. Chirální molekuly, které se k sobě mají jako zrcadlové obrazy (na všech centrech chirality mají opačnou konfiguraci jsou nazývány enantiomery. Každý enantiomer z dvojice enantiomerů je chirální.
Zobrazení různých stereoizomerů
|
Příklad chirálních molekul (enantiomerů) - zrcadlové obrazy, které jsou vzájemně neztotožnitelné
|
Enantiomery se vyskytují vždy v párech. Oba izomery páru mají za symetrických podmínek stejné fyzikální a chemické vlastnosti. Enantiomery mohou stáčet rovinu polarizovaného světla procházející vzorkem. Enantiomer stáčející rovinu polarizovaného světla ve směru hodinových ručiček je označován jako (+) a enantiomer otáčející rovinu polarizovaného světla proti pohybu hodinových ručiček je označován jako (-). Absolutní konfigurace v prostoru je na chirálních centrech označována jako R (rectus = pravý) nebo S (sinister = levý). Konfigurace chirálního centra s uspořádáním skupin podle klesající priority ve směru pohybu hodinových ručiček, díváme-li se ve směru vazby vedoucí ke skupině s nejnižší prioritou, je nazývána (R). Konfigurace chirálního centra s uspořádáním skupin podle klesající priority ve směru proti pohybu hodinových ručiček, díváme-li se ve směru vazby vedoucí ke skupině s nejnižší prioritou, je nazývána (S).
Priorita skupiny je řazení charakteristických funkčních skupin založené na protonovém čísle nuklidů (težší nuklid má přednost). Částečný seznam (podle klesající priority): I > Br > Cl > SO2R > SOR > SR > SH > F > OCOR > OR > OH > NO2 > NO > NHCOR > NR2 > NHR > NH2 > CX3 (X = halogen) > COX > COOR > COOH > CONH2 > COR > CHO > CR2OH > CH(OH)R > CH2OH > C ºCR > Cº CH > C(R)=CR2 > C6H5 > CH2 > CR3 > CHR2 > CH2R
> CH3 > D > H.
Diastereoisomery jsou stereoisomery látky, které nejsou svými zrcadlovými obrazy. Diasteroisomery se liší konfigurací na jednom nebo několika centrech, ne však na všech (pak by se jednalo o enantiomery). Jinak řečeno, diastereoizomery je vztah dvou isomerů sloučeniny se dvěma centry chirality, které se liší konfigurací pouze na jednom z nich. O diastereoizomerech platí, že jsou to látky s rozdílnými chemickými vlastnostmi, takže diastereoizomery je možné separovat. Obecně sloučenina, která má ve své molekule n – center chirality může existovat ve 2n prostorových isomerech. Kromě toho má 2n-1 možných párů enantiomerů a 2n-1 racemátů. Pokud má tedy látku se dvěma chirálním atomy, pak tvoří 4 diastereoizomery, dvě dvojice enantimoerů a dvě dvojice racemátů.
Chirální separace HPLC
Separace enantiomerů není možná za podmínek HPLC na běžných stacionárních fázích (C18, silikagel), ale uskutečňuje se za podmínek chirální chromatografie. Vznik diastereoisomerů, které dovolují separci páru enantiomerů, se může uskutečnit dvěma způsoby. První způsob je vznik tzv. transitního diastereisomeru, který vzniká mezi chirální stacionární fází (CSP) nebo chirálním aditivem v mobilní fázi a enatiomerem během chromatografické separace. Tento proces se pak nazývá přímá separace. Druhý způsob je vznik diastereoisomerů, které vznikají chemickou reakcí mezi chirálním činidlem a párem enantiomerů. Pak se mluví o nepřímé separaci, která probíhá v achirálním prostředí.
Pokud máme racemickou sloučeninu ±A a chceme ji rozdělit chirálně rozdělit pomocí chirálního selektoru +S, pak musí vzniknout dva diastereoizomery:
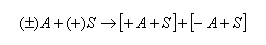
|
Chirální derivatizace probíhá reakcí chirální molekuly s chirálním derivatizačním činidlem na dva diastereomerní deriváty, které mohou být poté separovány pomocí konvenční chromatografie jak na normální tak na reverzní fázi. Tento způsob byl používán pro separaci diastereomerních amidů, karbamátů a derivátů močoviny, ale dnes je zcela vytlačena jinými technikami. Hlavní nevýhodou chirální derivatizace je experimentální náročnost (příprava derivátu), nutnost použití opticky čistého derivatizačního činidla (enantiomerní čistota > 99%) a možnost racemizace. Výhodou je možnost použití konvenčních chromatografických kolon a dobrá selektivita diastereomerů. Jedná se o nepřímou techniku dělení, separace probíhá v nechirálním prostředí.
Přídavek aditiva do mobilní fáze vede ke vzniku diastereomerního komplexu, který může být následně separován na konvenčních chromatografických kolonách. Jednotlivé enantiomery se separují na základě tvorby různě stabilních diastereoizomerních komplexů s chirálním selektorem. Tento způsob separace není příliš rozšířen z důvodu nižší selektivity a účinnosti chromatografického systému a chirální aditiva jsou příliš drahá, často komerčně nedostupná nebo se v mobilní fázi rozkládají. Slouží spíše jako screeningová metoda, následně je pak používána chirální stacionární fáze.
Chirální selektor je chemicky nebo dynamicky vázán na vhodný nosič dává vzniku CSP. Jako nosič se používá silikagel nebo různé polymery. Vazba mezi nosičem a chirálním selektorem může být kovalentní nebo iontová nebo může být nosič dynamicky pokrytý.
Podstatou chirální separace se zabývalo několik studií[1],[2],[3] a popisuje se na základě různých interakcí analytu a chirální stacionární fáze. Schopnost tvorby krátkodobého diastereomerního komplexu je založena na využití tvorby vodíkových vazeb, komplexů, p-p interakcí, dipól-dipólových interakcí a stérických efektů. Byla diskutována teorie, že k rozlišení dvou enantiomerů je zapotřebí minimálně tří simultánně působících interkací mezi analytem a chirální stacionární fází.[4],[5],[6] Nejdůležitějším faktorem v chirální chromatografii zůstává ale chirální stacionární fáze. Separace enantiomerů na CSP závisí objemové frakci organického rozpouštědla, pH, teplotě a koncentraci a typu pufru. V současné době existují čtyři hlavní typy chirální stacionární fáze: proteinová, cyklodextrinová, polysacharidová (na bázi amylosy nebo celulosy) a Pirklovy stacionární fáze. Dále existují ještě CSP méně rozšířené, které jsou komerčně dostupné a nebo se vyvíjí - chirální ligand-výměnná chromatografie (LEC), chirální "crown ethery", enzymy s vysokou stereoselektivitou pro určité substráty (chymotrypsin – L-aminokyseliny) na silikagelu, syntetické polymery a makrocyklická antibiotika (vancomycin, teicoplanin, ristocetin).
Dále budou uvedeny nejběžněji dosupné chirální stacionární fáze, kde budou zmíněny jednotlivé CSP, komerčně dostupné kolony a jejich výrobci.
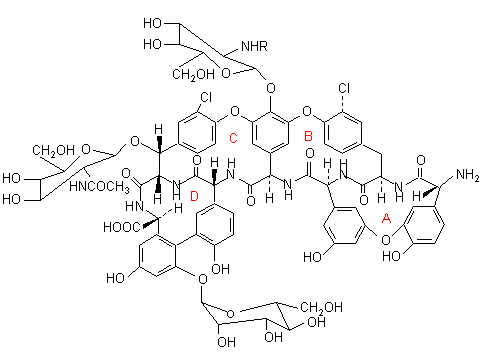
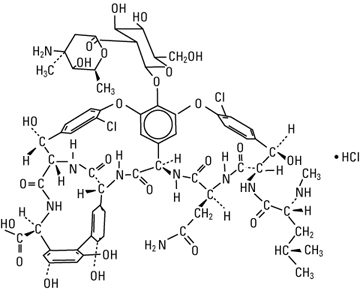
CHIROBIOTIC je název pro chirální kolony firmy Astec na bázi makrocyklických glykoproteinů. Jako makrocyklická antibiotika se používají: - vancomycin (CHIROBIOTIC™ V), který má 18 chirálních center; - teicoplanin (CHIROBIOTIC™ T) obsahuje 23 chirálních center a Ristocetin A (Chirobiotic™ R). U těchto SCP existuje velká pravděpodobnost tvorby diastereomerních komplexů s analytem a tudíž vysoká pravděpodobnost chirální separace. Vancomycin, teicoplanin a ristocetin A jsou fermentačním produktem Streptomyces orientalis, Actinoplanes teichomyseticus a Nocardia lurida. Všechny tři antibiotika se skládají s aglykonového "košíčku" tvořeného makracoyklickým kruhem a peptidickým řetězcem s různým počtem ethericky vázaných cukerných jednotek. Makrocyklické glykoproteiny jsou kovalentně vázány na silikagel (4 vazby a více).
|
Teicoplanin
|
Vancomycin
Tyto CCPs jsou velmi selektivní v reverzním (vodné prostředí), normálním (nevodné prostředí) i polárním módu (nevodné prostředí). Selektivita u těchto CSPs je ovlivněna zejména složením mobilní fáze (koncentrace a pufr), pH, organickým modifikátorem a teplotou. pH mobilní fáze je ale limitováno v rozmezí 3,5- 7,0 (z důvodu hydrolýzy nosiče a chirálního selektoru).
V polárním módu se používá jako mobilní fáze bezvodý methanol nebo acetonitril s přídavkem kyseliny (octová, trifluoroctová, mravenčí), báze (triethylamin, diethylamin, ethylendiamin) nebo pufru (směs výše uvedených kyselin a bazí, octan nebo mravenčan amonný). Selektivita je pak ovlivněna koncentrací těchto aditiv. V reverzním módu je selektivita ovlivněna pH, koncentrací a složením vodných pufrů a koncentrací organických modifikátorů (methanol, acetonitril, tetrahydrofuran, dioxan, ethanol, propanol).
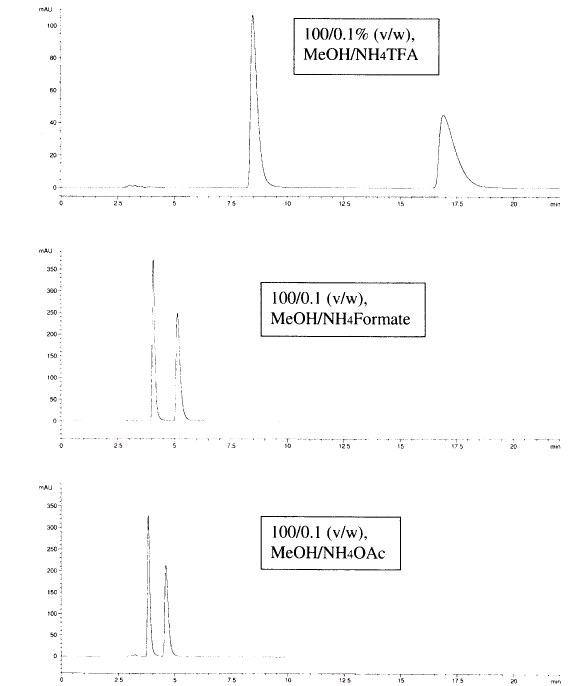
Vliv použitého pufru trifluorocan amonný (NH4TFA), mravenčan amonný (NH4Formate) a octanu amonného (NH4OAc) na selektivitu separace Mianserinu na koloně Chirobiotic V2 (250x4,6 mm), průtok 1 ml/min:
|
Vlastnosti
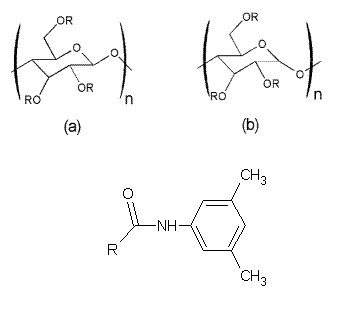
Přírodní polysacharidy jako se amylosa a celulosa jsou opticky aktivní látky díky jejich asymetrické struktuře. Proto mají potenciál se uplatnit při chirálních separací opticky aktivních látek v kapalinové chromatografii.[7] Celulosa je polymer, který je tvořen D-(+) glukosovými jednotkami spojené ß-1,4-glykosidickou vazbou. Stupeň polymerizace dosahuje 200 - 14 000 jednotek. Amylosa je tvořena 500-20 000 D-(+) glukosovými jednotkami spojené a-1,4-glykosidickou vazbou. Samotná celulosa nebo amylosa se však jako chirální selektor neosvědčily z důvodu nízké selektivity a problémy s jejich manipulaci. Z tohto důvodu se uplatňují pouze jejich deriváty. Jako první byly připraveny trikarbamáty (triphenylcarbamáty).[8]
Derivatizované polysacharidy mohu být na nosič (silikagel) kovalentně navázány (imobilizovány) nebo pouze naneseny (tzv. coating). Tím se liší i ve své selektivitě a použitelnosti. Kovalentně vázané jsou robustnější vůči tlaku, teplotě a použité mobilní fázi. Přesto jsou oba typy komparativní.
Komerčně dosupné CSPs
CHIRALPAK je název pro chirální kolony firmy Daicel (Daicel) na bázi derivatizované amylosy nebo celulosy. Jako chirální selektor se používá např. tris 3,5-dimethylphenylcarbamate, který může být vázán na 5 µm silikagel tzv. coatingem (Chiralpak AD nebo AD-H) nebo kovalentní vazbou (Chiralpak IA /amylosa/ nebo Chiralpak IB /celulosa/):
|
CHIRALCEL je název pro chirální kolony firmy Daicel na bázi derivatizované celulosy. Jako chirální selektor se používá např. tris 3,5-dimethylfenylkarbamát (Chiralcelk OD nebo OD-H); tris (4-methylbenzoate) (Chiralcel OJ); triacetate (Chiralcel OA); tribenzoate (Chiralcel OB); tris (4-chlorophenylcarbamate) (Chiralcel OF) aj. Struktury komerčně dostupných polysacharidových CSPs.
Enantioselektivita
I když existuje řada komerčně dostupných polysacharidových CSPs, na kterých byla rozdělena řada látek, predikce výběru nejlepší CSPs pro chirální separaci dané sloučeniny je téměř nemožná. Často postačuje k úspěšné separaci pouze jediná funkční skupina molekuly, jindy je zapotřebí určitého prostorového (geometrického) uspořádání molekuly k dosažení úspěšné separace. Vždy se tudíž jedná o kombinaci chirálního selektoru CSPs, polysacharidu (amylosa, celulosa), mobilní fáze a separované molekuly samotné. Mechanismus separace může také ovlivnit molekulová hmotnost a polydisperzita polysacharidu.[9] Obecně lze říci, že imobilizované CSPs jsou více stabilní, ale bylo pozorováno, že jejich enantioselektivita je vesrovnání s nanesenými CSPs menší. Toto je dáno zhoršenou stereospecifickou konfigurací imobilizovaných CSPs ke které dochází během jejich imobilizace na povrch nosiče. Jak bylo řečeno, imobilizované CSPs jsou chemicky vázané na silikagel pomocí hydroxylové skupiny polysacharidu, což je příčinou snížení chirální diskriminace.[9a]
V důsledku různé konformace amylosy (šroubovité uspořádání) a celulosy (lineární uspořádání) je na obou CSPs se stejným chirálním selektorem dosaženo různé enantioselektivity.[9b] V literatuže bylo pospáno, že amylosa vykazuje lepší chirální selektivitu ve srovnání s celulosou. Také je popsáno, že reverzní mód vykazuje obecně lepší selektivitu v porovnání s módem normálním. Toto je s největší pravděpodobností dáno tím, že v reverzním módu přibývá, mimo jiné, k dalším efektům ještě solvatace CSPs a separované molekuly. V normálním módu může být rovněž potlačena tvorba vodíkových vazeb v případě použití aprotních rozpouštědel.
Schopnost chirální diskriminace různých selektorů vázaných na polasacharidy, zejména vliv phenylkarbamátových derivátů, byl intenzivně studován.[10],[11]
Optimalizace separace
Chirální separace je ovlivňována řadou experimentálních parametrů a je závislá na separačním módu, který se používá (reverzní, polární nebo normální mód). Byla popsána řada postupů při vývoji chirální separace, které jsou založeny na znalostních databázích a každý postup zahrnuje většinou screening a optimalizační fázi. Nevýhodou těchto postupů je právě nutnost přístupu do znalostních databází a nutnost mít k dispozici velký počet CSPs.[12] Jeden z nejdůležitějších parametrů při chirální separaci je výběr mobilní fáze. Výběr mobilní fáze závisí na použitém módu, rozpustnosti analytu a jeho struktuře. Obecně, v normálním módu se používá směs n-alkanů (hexan) s přídavkem nižších alkoholů (ethanol, 2-propanol). V případě separace bazí nebo kyselin se pak používá přídavek aminů (triethylamin, diethylamin, ethylendiamin) nebo kyselin (octová, trifluoroctová) v množství 0,01 - 1,0 %. Vlastnosti a koncentrace alkoholů má vliv na enanatiomerní rozlišení a retenci, ale nelze toto predikovat, většinou se zvyšující se koncentrací alkoholu klesá retence i rozlišení.[13]. Druh alkoholu a jeho koncentrace může mít zásadní vliv na retenci i selektivitu. Struktura modifikátoru má vliv na stereoselektivitu, ale významnou roli hrají i stérické efekty mezi analytem a CSPs.[14]
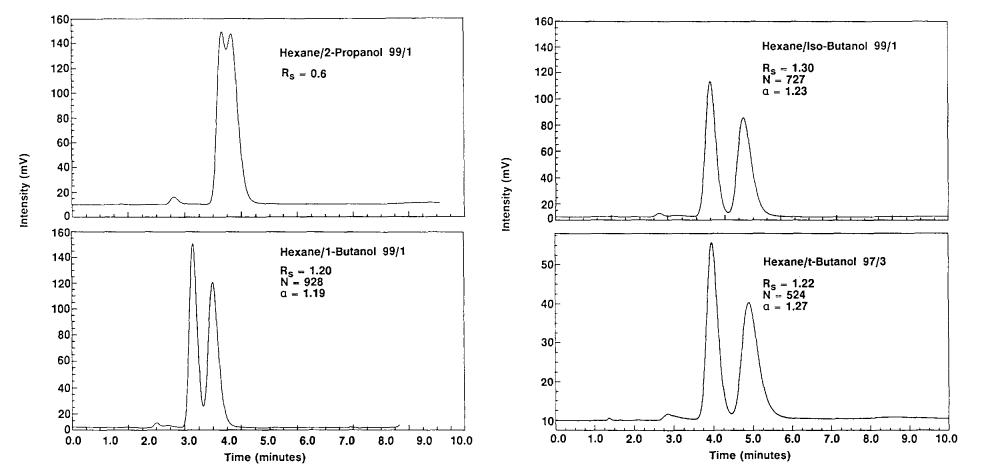
|
Vliv alkoholu jako modifikátoru mobilní fáze na separaci chirálních esterů. Kolona: Chiralcel OD 5x0.46 mm. Citace: [14a]
Použití aprotních rozpouštědel v polárním nebo normálním módu může na některých polysacharidových CSPs vést ke zvýšení enenantioselektivity.[14a] Ve srovnání s alkoholy, aprotická rozpouštědla omezují vznik tvorby vodíkovách vazeb mezi solventem a CSPs a podporuje se tak tvorba těchto vazeb mezi analytem a CSPs. V normálním módu se pak jako modifikátor mobilní fáze používá methyl-terc-butyl ether, dichlormethan nebo ethylacetát. Obsah těchto modifikátorů v mobilní fázi je však limitován v závislosti na používané CSP.
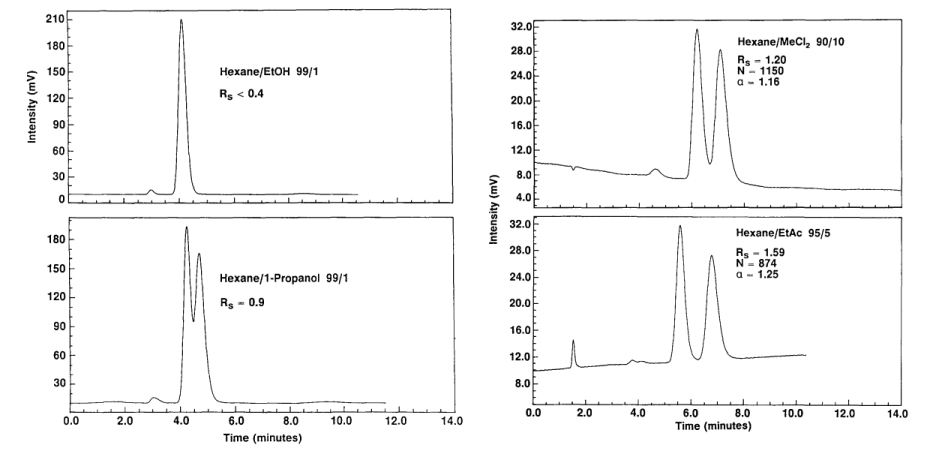
|
Vliv aprotické mobilní fáze na separaci chirálních esterů. Kolona: Chiralcel OD 5x0.46 mm. Citace: [14a]
Výběr mobilní fáze v reverzním módu je omezen. Jako mobilní fáze se používá voda nebo vodné pufry (fosfáty, octany, mravenčany, chloristany) ve směsi a acetonitrilem nebo vodou mísitelnými alkoholy. Velkou výhodou je možnost změny pH mobilní fáze, která má velký vliv na retenci i selektivitu separace. Proto se většinou separace optimalizuje změnou koncentrace organického modifikátoru a pH mobilní fáze. pro kyselé analyty se většinou používají kyselé mobilní fáze k potlačení disociace těchto kyselin a k zamezení iontových interakcí s povrchem silikagelu. Naopak báze vyžadují pH mobilní fáze > 7. Enantioselektivita může být také ovlivněna polaritou mobilní fáze a iontovou silou. Selektivitu mohou zvýšit i koncentrace a druh přítomných kationtů v mobilní fázi (Na+, Li+, K+, NH4+, N(C2H5)3+).[15]
Rozlišení u chirálních separací může být úspěšně ovlivněno průtokem mobilní fáze, ale počet publikací věnující se optimalizaci průtoku mobilní fáze je malý. [16] Většinou je lepšího rozlišení dosaženo při nízkém průtoku mobilní fáze, kde většinou dosáhneme optimum van Deemterovy křivky (zvýší se účinnost separace a tím i selektivita). Toho je ale dosaženo za cenu zvýšení doby analýzy.
Teplota hraje v chromatografické separaci významnou roli a vliv teploty na retenci byl popsán zde. Predikce, jaký příspěvek van´t Hoffových závislostí převáží a zda se selektivita zvýší nebo sníží, je obtížný a zjišťuje se experimentálně. Vliv teploty na retenci a rozlišení byl pospán např. v práci.[17] Bohužel, optimalizace teploty je často opomíjena a autoři ji věnují málo pozornosti.
Vlastnosti
První zmínka o crownetherech byla v roce 1967.[18] Jedná se o syntetické makrocyklické polyethery obsahující ethylenoxidový můstek (-CH2CH2O-).
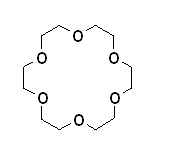
|
18-crown-6-ether
Počet ethylenoxidových můstků pak určuje specifickou velikost kavity, kterou crownethery tvoří. Atomy kyslíku pak vystupují jako donorové ligandy elektronů. Chirální crownethery vznikají začleněním chirální molekuly do struktury crownetheru. Těchto molekul může být celá řada, ale jako CSP se používá výhradně 3,3-diphenyl-1,1´-binaphtyl (1) nebo kyselina vinná (2):
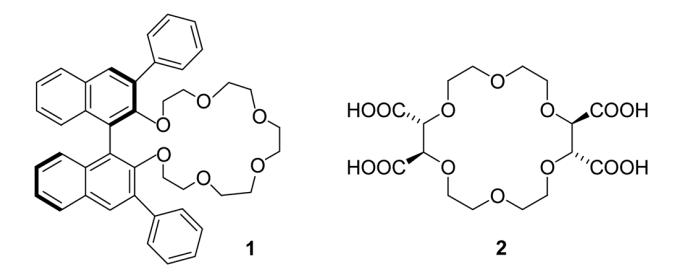
|
Chirální crownetherové selektory CSPs
Dále také byly pospány směsné chirální selektory výše dvou uvedených chirálních selektorů: [19]
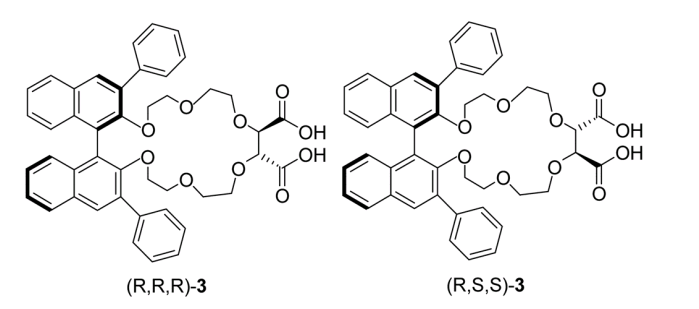
|
Stacionární fáze a enantioselektivita
(3,3-diphenyl-1,1´-binaphtyl)-20-crown-6-ether byl prvně úspěšně použitý jako chirální selektor a to jako aditivum do mobilní fáze methanol-voda (kolona LiChrosorb RP-18).[20] Chirální selektor se dynamicky váže svou lipofilní částí na povrch oktadecylu a tvoří tak CSP (CSP1). Tato fáze je úspěšně komerčně dodávána jako CROWNPAK CR (+) nebo CR (-) chirální kolony firmy Daicel. Diastereoizomerní komplex vzniká mezi chirálním selektorem a amoniovým iontem. Tyto CSPs jsou tudíž vhodné k separaci primárních aminů, kdy aminoskupina leží blízko chirálního centra (a-aminokyseliny). CSPs CR (+) a CR (-) jsou navzájem komplementární. Jako mobilní fáze se používá kyselina chloristá o pH 1-2. Čím nižší pH mobilní fáze, tím je selektivita vyšší, ale životnost kolony se snižuje. Mobilní fáze může být modifikována rovněž methanolem (max. 15 %). Vyšší obsah methanolu je příčinou vymývání chirálního selektoru z kolony. Zvýšením obsahu obsah alkoholu dochází ke snížení retence ale naopak selektivita vzrůstá.[21] Selektivitu separace je možné ovlivnit také teplotou. Bylo pozorováno, že v případě separace primárních aminosloučenin, snížení teploty vede vždy ke zvýšení retence i selektivity.
Dynamicky vázaný chirální selektor (CSP1) má nevýhodu v limitaci použití alkoholu v mobilní fázi, proto se vyvinuly CSPs, kde je chirální selektor [(3,3-diphenyl-1,1´-binaphtyl)-20-crown-6-ether] vázán na oktadecyl (CSP2) nebo přímo na silikagel (CSP3). Pak je stabilita těchto CSPs vyšší a obsah akholu je 40 % pro (CSP2) resp. není obsah limitován vůbec pro (CSP3). Jak již bylo řečeno, nejčastěji se jako mobulní fáze používá kyselina chloristá, ale jako alternativu ke kyselině chloristé je možné použít kyselinu dusičnou, trifluoroctovou[22] nebo sírovou.[23]
K redukci retence silně lipofilních sloučenina (např. alanin-ß-naphtylamin) je možné použít jako modifikátoru mobilní fáze kationtů, přičemž retence klesá s přídavkem kationtu v pořadí Li+ > Na+ > NH4+ > K+. [24] Stabilita komplexu mezi crownetherem a kationtem závisí na velikosti kationtu (Li+ = 1,36 A; K+ = 2,66 A). Toto platí pro (CSP1), pro (CSP3) je přídavek kationtu do mobilní fáze nezbytný, protože retence je na této CSP příliš velká i v případě vysokého obsahu alkoholu.[25]
Vlastnosti
Cyklodextriny (CDs) byly porpvé izolovány v roce 1891 jako degradační produkt škrobu a později byly charakterizovány jako cyklické oligosacharidy. [26] Tyto CDs vznikají nespecifickou enzymatickou hydrolýzou a proto vzniká celá řada CDS, z nichž nejvýznamnější jsou a-, ß- a g-cyklodextrin (a-CD, ß-CD a g-CD), které obsahují šest, sedm resp. osm glukosových jednotek.
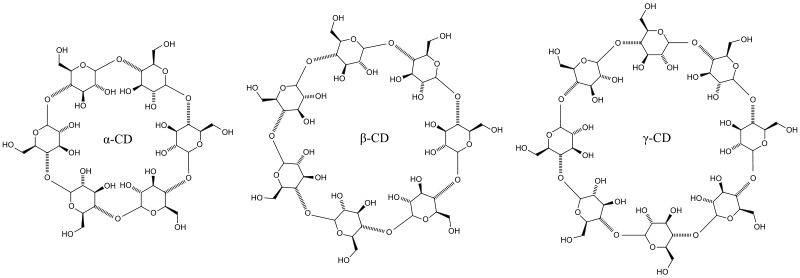
|
Obrázky převzaty z Wikipedie
Všechny glukosové jednotky jsou vázány a (1 -> 4) glykosidickou vazbou. Geometrické uspořádání glukosových jednotek tvoří dutý kužel - kavitu. Proto se také těmto CSPs říká v anglické literatuře "cavity-type CSP". Na vnějším širším okraji kavity se nacházejí sekundární hydroxylové skupiny a užší okraj je obklopen primárními hydroxyly. Z tohoto důvodu je vnějšek kavity hydrofilní, zatímco vnitřek, kam jsou orientovány etherické kyslíky a vodíky, má lipofilní charakter.
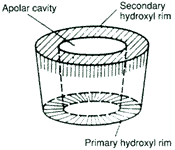
|
Obrázek převzat z CTD, Inc.
Tvorba komplexů
Proto mohou nepolární části molekul (tzv. host)snadno vnikat (inkludovat) dovnitř cyklodextrinového kruhu (tzv. hostitel). Tento jev probíhá nejčastěji ve vodě nebo ve směsi vody a jiného polárního rozpouštědla a vznikají tzv. inkluzní komplexy. Host je v makrocyklu stabilizován van der Waalsovými, disperzními, případně vodíkovými vazbami. Inkluzní komplexy jsou charakterizovány konstantami stability, které jsou zodpovědné za retenci jednotlivých analytů. Velikost kavity pak určuje, jestli dojde k tvorbě inkluzního komplexu či nikoliv. Je-li nepolární část molekuly větší než kavita, pak jsou inkluzní komplexy velmi málo stabilní nebo nevznikají vůbec. To pak přednostně určuje zda-li může dojít k chirálnímu rozlišení.
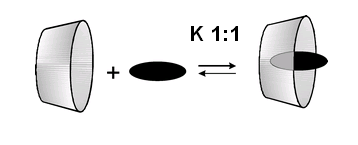
|
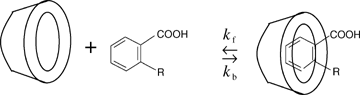
|
Inkluzní komplex
Enantioselektivita a ovlivnění separace
Z výše uvedeného vyplývá, že k chirální separaci na cyklodextrinové fázi může déjít tehdy, dochází-li k tvorbě inkluzního komplexu (molekula inkluduje do kavity); aromatický nebo cykloalkylový kruh je blízko chirálního centra molekuly a další substituent může interagovat s hydroxylovými skupinami CD (van der Waalsovy, disperzní síly nebo vodíkové vazby). Největší uplatnění našel ß-CD. a-CD se uplatňuje při separaci malých molekul, naopak g-CD je vhodný pro separaci molekul velkých (např. obsahující tři a více aromatických kruhů - chrysen, pyren aj.).
Chemickou modifikací je však možno cíleně měnit fyzikálně-chemické vlastnosti CD a vznikají deriváty, které vykazují lepší rozpustnost ve vodě i v organických rozpouštědlech. Chemická modifikace má velký význam, protože se pak v závislosti na modifikaci docílí různé chirální diskriminace. Derivatizace CD se uplatNúje přes hydroxylové skupiny a mohou vznikat estery, ethery nebo karbamáty. CYCLOBOND je název pro chirální kolony firmy ( Astec) na bázi ß-CD. CD je chemicky (kovalentně) vázán na povrch silikagelu. Tento cyklodextrin může být dále modifikován dalším chirálním selektorem - peracetylovaný cyklodextrin (CYCLOBOND I 2000 AC); - derivát naphthylethyl karbamát (CYCLOBOND I 2000 SN); - derivát R-naphthylethyl karbamátu (CYCLOBOND I 2000 RN); - S-hydroxypropyl etherový derivát (CYCLOBOND I 2000 SP); - 3,5-dimethylphenyl karbamát (CYCLOBOND I DMP).
Chirální separaci je na CD možno uskutečnit ve třech chromatografických módech: normální mód, polární mód a reverzní mód. Výběr módu z velké části závisí na rozpustnosti analytu, pokud je analyt rozpustný pouze v organických rozpouštědlech, je nutné použít polární (mobilní fáze je 100 % acetonitril nebo methanol s přídavkem bazí nebo kyselin) nebo normální mód (mobilní fáze - směs alifatických uhlobodíků /hexan/ s alkoholy). Pokud je analyt rozpustný pouze ve vodě, pak je vhodný reverzní mód. Je-li analyt rozpustný ve vodě i organických rozpouštědlech, mohou se použít všechny tři módy pospané výše. Obecně, dosažení úspěšné enantioseparace klesá v řadě reverzní mód > polární mód > normální mód.
V reverzním módu na nederivatizovaných CD je hlavní procesem enantioseparace tvorba inkluzních komplexů.[27] Koncentrací organického modifikátoru je pak možné kontrolovat jednak retenci a současně i ovlivňovat selektivitu. Jako modifikátory se používají methanol, acetonitril, 2-propanol a ethanol. Bylo pozorováno, že se zvyšující se koncentrací acetonitrilu klesá retence analytu až do určitého bodu, kdy začne opět narůstat. Toto chování svědčí o změně v retenčních interakcí.[28] Selekivitu a retenci je možné dále ovlivnit změnou pH a iontovou silou (koncentrací pufru) mobilní fáze. Použití pufrů vede ke zlepšení účinnosti a reprodukovatelnosti separace na CD. Příliš se nedoporučuje použití fosfátových pufrů, protože dochází k rozpouštění silikagelu jako nposiče a preferují se pufry organických kyselin a bazí (octany, citráty, mravenčany, triethylamin). Velmi důležitou roli hraje volba pH mobilní fáze, neboť ovlivňuje tvorbu a stabilitu inkluzního komplexu. Toto platí samozrejmě pro ionizovatelné analyty, neutrální molekuly tvoží silné inkluzní komplexy nezávislé na pH prostředí. pH mobilní fáze pro ionizovatelné analyty má významný vliv jak na retenci tak enantioselektivitu. Obecně platí, že pH moblní fáze by se mělo testovat v rozmezí pH 4 - 7 nebo ± 0,5 pH jednotek pK analytu. Jakmile je nalezeno optimální pH mobilní fáze, může se rovněž optimalizovat koncentrace a druh pufru (kationty) a průtok mobilní fáze. Pokud použitý pufr může inkludovat do kavity CD, pak jeho výběr hraje velkou úlohu při separaci samotného analytu, protože může konkurovat tvorbě inkluzních komplexů. Stejně tak hraje roli i koncentrace pufru, kdy obecně platí, že se zvyšující se koncentrací pufru klesá retence.
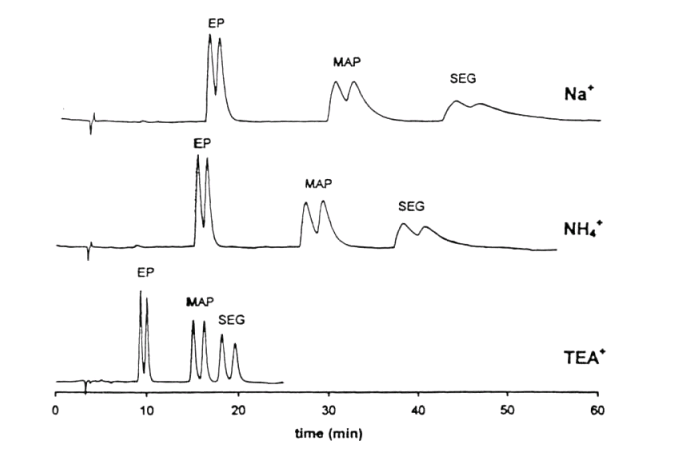
|
Vliv druhu kationtu na separaci ephedrinu (EP), methamphetaminu (MAP) a selegilinu (SEG). CSP: Chiradex, 5 µm. Citace: [28a]
Průtok mobilní fáze má vliv na účinnost separace, ale v jistých případech může tvorbě inkluzního komplexu bránit převod hmoty mezi stacionární a mobilní fází. To má za následek nízkou účinnost separace a snížení lineární rychlosti mobilní fáze může zvýšit účinnost systému. Posledním důležitým parametrem je teplota, která má vliv jak na retenci tak selektivitu. Zvýšením teploty se dosáhne zvýšení účinnosti, ale většinou na úkor enantioselektivity. Rovněž snížení teploty (5-15 °C) může vést k úspěšné separaci.
Polární mód používá jako mobilní fázi acetonitril nebo methanol s přídavkem kyseliny, báze nebo jejich solí ke kontrole retence, selektivity a účinnosti systému. Pokud se používá jako mobilní fáze acetonitril, pak dovnitř kavity CD vzniká scetonitril a zcela ji vyplňuje. Pokud dochází k tvorbě inkluzního komplexu mezi analytem a CD, pak je acetonitril v kavitě převážně nahrazen analytem. Protože je ale acetonitril polární aprotické rozpouštědlo, je tvorba vodíkových můstků mezi hydroxylovými skuponami CD a analytem limitována. Z tohoto důvodu je vhodné do mobilní fáze přidávat báze, kyseliny nebo samotný methanol, které umožňují tvorbu těchto vazeb.[29]
Normální mód se na nederivatizovaných CD používá vyjímečně a spíše je vhodný pro výše pospané derivatizované CD.[30] Alifatické uhlovodíky mobilní fáze zaujímají vnitřek kavity a analyty interagují s hydroxylovými skupinami na povrchu CD. Tvorba inkluzních komplexů je znemožněna nebo se netvoří vůbec. Enantioselektivita se ovlivňuje polárními modifikátory jako jsou alkoholy (2-propanol, butanol), v některých případech se může použít dichlormethan nebo ethylacetát.
Glykoproteiny jsou vysokomolekulární komplexy proteinu, skládající se z řětězců L-aminokyselin spojených peptidickou vazbou. a1-acid glycoprotein (AGP) je velmi stabilní protein, který je odolný vůči organickým rozpouštědlům, vysokým i nízkým hodnotám pH a je odolný vůči širokému rozmezí teplot. AGP je vtořen 181 aminokyselinami a 14 molekulami sialové kyseliny. Molekulová hmotnost proteinu AGP je 141 000 Da, isolelektrický bod PI = 2,7 a obsahuje 45 % cukerných jednotek.
Ovomucoid (OVM) je trypsinový inhibitor, který se získává z vaječných bílků. Tento protein je imobilizovaný přes aminopropyl na silikagel. OVM má molekulovou hmotnost 28 800 Da, isoelektrická bod pI je 3,7-4,5 a obsahuje asi 30 % cukerných jednotek.
Hovězí sérum albumin (BSA - bovine serum albumin) je kulovitý protein obsahující 581 aminokyselin stabilizovaný 17 disulfidickými můstky. Molekulová hmotnost je 66 000 Dam isoelektrický bod 4,7. BSA je vázán na silikagel několika způsoby.
Chirální selektor je imobilizován na 5 µm silikagelu. CHIRAL-AGP je název pro chirální kolony firmy Astec. Nevýhodou těchto stacionárních fází je nízká kapacita (max. 0,1 mg/mL; viz dále ) a tlakový limit kolony (max. 600 psi). pH mobilní fáze je omezeno na rozmezí 4 - 7. Jako organický modifikátor se používá propanol, methanol, ethanol nebo acetonitril. Se stoupající koncentrací organického rozpouštědla klesá dramaticky retence. Eluční síla klesá pv řadě acetonitril > 2-propanol > ethanol > methanol. Velký vliv na retenci a enantioselektivitu má pH mobilní fáze, iontové síla a tvorba iontových párů. Retence analytu závisí na náboji stacionární fáze a je největší, když náboj CSP je opačný a maximální. Náboj AGP jako CSP můžeme odvozovat od hodnoty pI, ale ani při tomto pH mobilní fáze nemá AGP nulový náboj a to díky nestejnorodé distribuci náboje na imobilizovaném proteinu. Se zvyšujícím se pH mobilní fáze roste záporný náboj CSP a retence kyselin jako analytu klesá a podobně retence bazí stoupá. K optimálnímu dosažení enantioselektivity je vhodné, aby náboje analytu a CSP byly obrácené. Proto bylo také pozorováno, že malá změna pH může způsobit velkou změnu v retenci nebo enantioselektivitě. Obecně se doporučuje na glykoproteinových CSP separovat kyseliny při pH < 6 a báze při pH > 6.
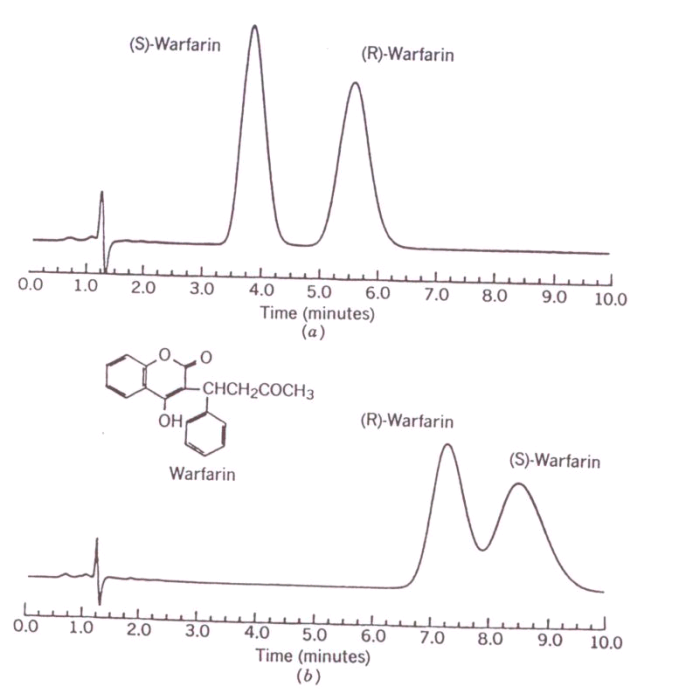
|
Vliv organického modifikátoru na retenci a enantioselektivitu warfarinu. Kolona: Chiralpak AGP, 4.0x100 mm.
Teplota: 30 °C. Mobilní fáze a) 2-propanol-10 mM Na2HPO4 pH 6,5 (15+85); mobilní fáze b) acetonitril - 10 mM Na2HPO4 pH 6,5 (15+85). Citace: [31]
Iontová síla má daleko menší vliv na retenci a selekivitu než pH mobilní fáze. U neutrálních molekul dochází se zvýšením iontové síly ke zvýšení retence (uplatňují se hydrofóbní interakce). Selektivita může být ovlivněna přídavkem malé koncentrace hexanové, heptanové nebo oktanové kyseliny, tetraethyl- a tetrapropylamonium bromidu nebo N,N-dimethyloktylaminu (1-20 mM). Použití iontových párů vede ke zvýšení retence a může ovlivnit enantioselektivitu.
Glykoproteinové kolony mají ve srovnání s konvečními kolonami menší kapacitu a koncentrace vzorku nesmí být příliš vysoká. Se zvyšující se koncentrací dramaticky klesá účinnost.[32] K separaci se většinou používá laboratorní teplota, za vyšší teploty > 40 °C může docházet k racemizaci chirálních analytů nebo může docházet k denaturaci stacionární fáze. Racemizace je ukázána na obrázku níže, kdy je zřejmá konverze jednoho enantiomeru v druhý během separace, což se projevuje tvorbou "plata" mezi oběma píky enantiomerů.[33] Snížením teploty < 15 °C dochází ke snížení retence, vliv na enatioselektivitu se však nedá predikovat.
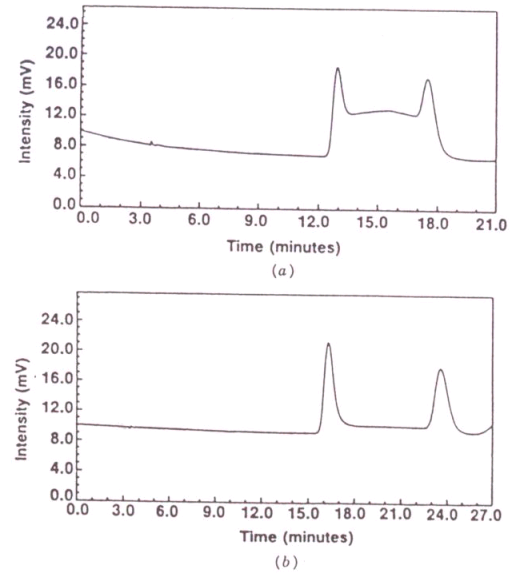
|
Vliv teploty na separaci lorazepamu. Kolona: Ultron ES-OVM, 6.0x150 mm. Mobilní fáze aacetonitril-10 mM Na2HPO4 pH 6 (12+88). Teplota a) 35 °C, b) 10 °C.
Princip ligandové výměny (LEC - ligand exchange chromatography) byl popsán Davankovovou skupinou v 60. a 70. letech 20 století. Termín "ligandová výměna" použil pak poprvé Helfferich.[34] Enantioseparace prostřednictvím výměny ligandů je založena na tvorbě koordinačních komplexů skládajících se z centrálního iontu přechodného kovu a minimálně dvou chirálních bifunkčních ligandů (chirálního selektoru a separovaného enantiomeru). Koordinační komplexy jsou charakterizovány konstantami stability, které jsou závislé na geometrii a orientaci ligandů vznikajících ternárních komplexů a na vzájemných interakcích selektoru s jednotlivými enantiomery. Separace pak probíhá u těch komplexů, jejjichž konstanty stability jsou dostatečně odlišné. Dvojice separovaných enantiomerů musí obsahovat alespoň dvě funkční skupiny schopné poskytovat elektronový pár centrálnímu kovu. První chirální kolona byla připravena chemickým navázáním aminokyseliny (L-prolin) na poslystyren-divinylbenzenový nosič a jako kov byl použit CuSO4, přidaný do mobilní fáze jako aditivum.[35], [36] Tento typ kolon má však velmi malou účinnost díky použitému nosiči a proto později jako nosič byl použitý silikagel, což vedlo ke zvýšení účinnosti. Bylo prokázáno, že na enantioselektivitu má významný vliv způsob jakým je chirální ligand navázán na silikagel. Se stopající délkou alkylového řetězce, který složí k navázání chirálního liganud roste hydrofobní charakter CSP a roste i enantioselektivita. [37] Změna hydrofobicity stacionární fáze vede ke změně stérické orientace ligandu, což má pak za následek změnu enantioselektivity. pH mobilní fáze má vliv na stabilitu komplexů a tudíž i na retenci a enantioselektivitu. Přídavkem organického modifikátoru do mobilní fáze se ovlivňuje retence hydrofobních analytů, výzmnanou roli hraje průtok mobilní fáze, kdy se snižujícím se průtokem stoupá účinnost systému.[38]
LEC je vhodná pro chirální separaci aminokyselin, aminoalkoholů, hydroxykyselin tj. látek, které jsou schopné tvořit komplexy. Proto se příliš tato separační technika nepoužívá.
[1] Pirkle W.H., Pochapsky T.C.: Che. Rev. 89, 347 (1989).
[2] Pirkle W.H., Welch C.J., Hyun M.H.: J. Org. Chem. 48, 5022 (1983).
[3] Wagner I.W., Alembik M.C.: J. Chromatogr. 367, 59 (1986).
[4] Dalgleish C.E.: J. Chem. Soc. 137, 3940 (1952).
[5] Pirkle W.H., House D.W., Finn J.M.: J. Chromatogr. 192, 143 (1980).
[6] Wagner I.W., Doyle T.D.: J. Chromatogr. 259, 465 (1983).
[7] Yashima E., Okamoto Y. v knize The Impact of Stereochemistry on Drugs Development and USe, Aboul-Enein H.Y., Wainer I.W. (Ed.), Wiley, New York, str. 345-376, 1997.
[8] Okamoto Y., Kawashima M., Yamamoto K., Hatada K.: Chem.Lett. 13, 739 (1984).
[9] Shibata T., Okamoto I., Ishii K.: J. Liquid chromatogr. 9, 313 (1986).
[9a] Yashima E., Fukaya S., Okamoto Y.: J. Chromatogr. A 677, 11 (1994).
[9b] McCarthy J.P.: J. Chromatogr. A 685, 349 (1994).
[10] Okamoto Y.,Kawashima M.,Hatada K.: J. Chromatogr. 363, 173 (1986).
[11] Okamoto Y., Kaida Y.: J. Chromatogr. A 666, 403 (1994).
[12] Matthijs N., Perrin C., Maftough M., Massart D.L., Vander-Heyden Y.: J. Chromatogr. A 1041, 119 (2004).
[13] Bonato P.S., Pires de Abreau L.R., de Gaitani C.M., Lanchote V.L., Bertucci C.: Biomed. Chromatogr. 14, 227 (2000).
[14] Wainer I.W., Stiffin R.M., Shibata T.: J. Chromatogr. 411, 139 (1987).
[14a] Kirkland K.M., J. Chromatogr. A 718,9 (1995).
[15] Ishikawa A., Shibata T.: J. Liq. Chromatogr. 16, 859 (1993).
[16] Aboul-Enein H.Y., Ali I.: Pharmazie 57, 682 (2002).
[17] Kazusaki M., Kawabata H., Matsukura H.: J. Liq. Chromatogr. Relat. Technol. 23, 2937 (2000).
[18] Pederson C.J.: J. Am. Chem. Soc. 89, 2495 (1967).
[19] Yoon J.C., Hee J.C., Myung H.H.: Bull. Korean Chem. Soc. 28, 2531 (2007).
[20] Shinbo T., Yamaguchi T., Nishimura K., Suguita M.
[21] Walbroehl Y., Wagner J.: J. Chromatogr. A 680, 253 (1994).
[22] Lee W., Hong C.Y.: J. Chromatogr. A 879, 113 (2000).
[23] Hyun M.H., Han S.C.: J. Biochem. Biophys. Methods 54, 235 (2002).
[24] Machida Y., Nishi H., Kakamura K.: J. Chromatogr. A 830, 311 (1999).
[25] Hyun M.H., Min H.J., Cho Y.J.: J. Chromatogr. A 996, 233 (2003).
[26] Saenger W.: Angew. Chem. Int. Ed. 19, 344 (1980).
[27] Armstrong D.W., DeMond W.: J. Chromatogr. Sci. 22, 411 (1984).
[28] Seeman J.I., Secor H.V.: Anal.Chem. 60, 2120 (1988).
[28a] Lemr K., Jirovsky D., Ševčík J.: J. Liq. Chrom. Rel. Technol. 19, 3173 (1996).
[29] Berthod A., Berthod L., Armstrong D.W.: J. Liq. Chrom. Rel. Technol. 28, 1669 (2005).
[30] Armstrong D.W., Stalcup A.M., Hilton M.L., Duncan J.D., J.J.R. Faulkner, Chang S.-C.: Anal. Chem. 62, 1610 (1990).
[31] Williams R.C., Edwards J.F., Potter M.J.: J. Liq. Chromatogr. 16, 171 (1993).
[32] Kirkland K.M., Nielson K.L., McCombs D.A.: J. Chromatogr. 545, 43 (1991).
[33] Kirkland K.M., McCombs D.A.: J. Chromatogr. A 666, 211 (1994).
[34] Helfferich F.: Nature, 189, 1001 (1961).
[35] Davankov V.A., Rogozhin S.V.: J. Chromatogr. 60, 284 (1971).
[36] Davankov V.A.: Adv. Chromatogr. 18, 139 (1983).
[37] Roumeliotis P., Kurganov A.A., Davankov V.A.: J. Chromatogr. A 266, 439 (1983).
[38] Rizzi A.M.: J. Chromatogr. A 542, 221 (1991).
Last modified: